줄기세포를 이용한 난치성질환 의약품 개발 전문기업이다. 세계적으로 유력한 ALS(루게 릭병)치료제가 희소한 상황에서 비교적 명확한 임상결과를 통해 품목허가를 받고, 현재 국내에서 처방중인 ‘뉴로나타-알’의 효능에 주목한다. 또한, 연말부터 시작되는 건강보험 적용을 위한 협상 및 ’18년 미국 FDA 허가 신청에 대해 긍정적인 결과를 예상한다. 따라 서 ’19 년부터는 본격적인 매출 증가가 가능하다는 판단이다. 투자의견 매수, 목표주가 15,000 원으로 커버리지를 개시한다.
2019년 ‘뉴로나타-알’의 본격적인 매출 증가 기대
‘뉴로나타-알’은 임상시험에서 처방 6개월 후 신체기능 저하속도를 약 50%이상 완화시 키는 효과를 나타냈다. ’15년 2월 첫 환자투여를 시작한 이후 지난 9월말까지 약 150 명 정도의 환자가 처방을 받았으며, 특히 올해에는 마국 유명 대학병원에서 보내는 환자 수가 가파르게 증가하고 있는 추세이다. 당 연구원은 미국의 관련분야 최고 권위자들이 자신의 환자를 다수 보내고 있는 점에 주목하며, 이는 치료제로서 ‘뉴로나타-알’의 성공 가능성을 엿볼 수 있는 대목이라고 판단한다. 한편, 현재 동사는 ‘뉴로나타-알’의 국내 건강보험 등재를 위한 관련 기관과의 협상 및 미국 FDA 허가 신청을 위한 준비를 하고 있다. 국내 건강보험 등재를 위한 약가 협상이 연내에 시작될 것으로 예상하며, 향후 18 개월동안 ‘약가’를 얼마로 할 것인가에 대한 치열한 논의가 펼쳐질 것으로 전망된다. 또, 내년초에는 미국 FDA 접수를 위한 사전미팅이 예정되어 있다. ‘뉴로나타-알’의 임상시 험 결과가 비교적 명확하고, 최근 세포치료제에 대한 FDA의 ‘Fast – Track 적용’ 발표 에 따른 긍정적인 향으로 ’18년 연말경에는 FDA허가 가능성이 높다는 판단이다.
성장성과 안정성을 겸비한 자회사 켐온 보유
동사는 ’13년 자회사 켐온을 인수(지분 54.27%)했다. 켐온은 국내 Top3 비임상시험기 관이다. 최근 ‘화평법’의 확대추세에 따라 비임상CRO업체들이 주목받고 있다. 비임상 CRO사업은 진입장벽이 상당히 높은 사업이기에 ‘화평법’ 실행 및 확대에 따른 직접적 인 수혜가 가능하다는 판단이며, 따라서 켐온은 ‘뉴로나타-알’에 대한 매출 의존도가 높 은 동사의 재무적 안정성을 높이는데 지속적인 기여를 할 수 있다고 본다.
 |
줄기세포를 이용한 난치성질환 의약품 개발 전문기업
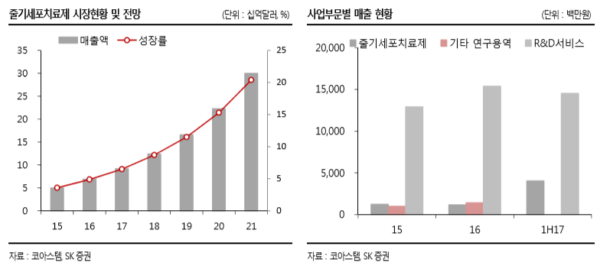
’03년도에 설립된 코아스템은 줄기세포를 이용한 난치성질환 의약품 개발 전문기업이 다. ’14년 1월에 세계에서 다섯번째로 희귀 난치성 질환인 루게릭병(ALS, 근위축성측 삭경화증)의 줄기세포 치료제인 ‘뉴로나타-알’ 개발에 성공하여 식품의약품안전처로부 터 희귀의약품으로 지정받았고, 같은해 9월 의약품 제조업 허가를 완료했다. 루게릭병 치료를 위한 세포치료제가 임상시험을 종료한 후 희귀의약품으로 지정받은 것은 세계 최초이다. 루게릭병 치료제인 ‘뉴로나타-알’외에도 루푸스(SLE : Systemic Lupus Erythematosus), 무산소성 뇌손상(ABI : Anoxic Brain Injury), 다계통위축증(MSA), 내 화성간질(Refractory Epilepsy) 등 다양한 질환의 파이프라인을 보유하고 있다. 전체 매 출비중(’16 년기준)은 줄기세포치료제 6%/줄기세포치료제 기술이전 8%/R&D 서비스 (켐온) 86% 이다. 자회사로는 동사가 54.27%의 지분을 보유하고 있는 ‘켐온’ 과 지분 100%를 보유하고 있는 ‘코아스템바이오’가 있다. 켐온은 신약/신물질 개발을 위한 비 임상 CRO사업을 위하고 있고, 코아스템바이오는 의약품 판매가 주된 사업이다.
동사의 주주구성을 살펴보면 지분 22.45%를 보유하고 있는 김경숙대표가 설립이래로 계속 최대주주이고, 주요주주로는 지분 6.58%를 보유한 벤처금융 성격인 서울글로벌 바이오메디컬신성장동력투자펀드가 있다. 최대주주인 김경숙 대표는 한양대 의과대학 진단검사의학과 전문의 출신이다. 한양대병원 재직시 제대혈줄기세포로 연골관련 연구 를 진행하다 동대학병원 신경과 김승현교수의 제안으로 ALS(루게릭병) 연구로 급전향 하게 된 것으로 알려져 있다.
 |
참고로 김경숙 대표에게 ALS(루게릭병)관련 줄기세포 연구를 제안한 한양대학교 김승 현교수에 대해 알아 둘 필요가 있다. 김승현 교수는 세계신경과학회(WFN) 산하의 ‘ALS /MND연구분과’에 등록된 아시아의 유일한 ALS Clinic의 Director 로서 ALS질 환의 원인과 치료에 관한 수많은 연구업적을 보유하고 있는 국내 최고의 권위자이다. 그리고 앞서 언급한 것 처럼 후배의사인 김경숙대표와 함께 줄기세포 치료제 ‘뉴로나타 -알’의 임상시험을 진두지휘 해왔고, 상용화 시키는데 절대적인 기여를 한 주인공이기 도 하다. 김승현교수는 지속적으로 ‘국제 ALS/MND 학회’에서 ‘뉴로나타-알’의 임상 및 처방 이후 연구결과를 발표해오고 있다. 금년 연말에도 미국 보스턴에서 ‘국제 ALS/MND 학회’에서의 ‘뉴로나타-알’관련 연구발표가 예정되어 있다.
줄기세포치료제 시장 현황 및 전망 지난 11 월에 발간된 미국의 시장조사업체 BBC 의 자료에 따르면 줄기세포치료제 시 장은 ’15 년 약 3 조 700 억원에서 연평균 15.4%씩 성장해 오는 ’18 년에는 약 5 조 4,600억원 에 이를 전망이다. 줄기세포치료제는 환자(or 정상인)로부터 추출한 줄기세 포를 체외에서 분화 및 증식시킨 후 환자에게 재주입해 손상된 세포나 조직을 대체하 는 치료제를 말한다. 특히, 줄기세포치료제는 이러한 재생능력으로 인해 의학적 수단이 없는 퇴행성 질환이나 희귀질환 등의 치료대안으로 대두되고 있다. 줄기세포 관련 연구 는 1999 년 미국에서 본격적으로 시작되었다. 연구 역사가 길지 않아 줄기세포치료제 대부분이 초기 임상에 머물러있다. 식품의약품안전처에 따르면 1999 년도 이래 2016 년까지 총 314 건의 줄기세포치료제 임상연구가 진행된 것으로 파악된다. 우리나라는 46 건으로 155 건의 미국에 이어 두번째로 줄기세포치료제 임상연구를 많이 실시하는 국가이다. 상용화에 근접해 있는 2/3상 및 3상 임상은 전체의 약 10%에 이르는 것으 로 파악된다.
세계적으로 판매허가를 획득한 줄기세포치료제는 6 개에 불과하다. 이 중 4 개가 국내 업체가 개발한 국산 제품이다. 세계 최조 줄기세포치료제는 파미셀이 2011년 국내 판 매허가를 받은 ‘하티셀그램-AML’이다. 다음해인 2012 년에는 메디포스트의 ‘카티스 템’과 안트로젠의 ‘큐피스템’이 판매허가를 받았다. 코아스템은 2014 년에 ‘뉴로나타알’ 판매허가를 승인받았다. 해외에서는 2012 년에 캐나다의 ‘프로키말’과 2015 년에 유럽의 ‘홀로클라’가 판매허가를 승인받은 바 있다.
 |
줄기세포치료제 시장의 성장 및 각국의 경쟁속도가 빨라지고 있다. 미국의 2016 년 2 월 정부-학계-산업계가 연계된 컨소시엄이 세포 제조에 대한 ‘국가기술 로드맵’을 발 표했다. 주된 내용은 향후 10년간 세포치료제에 대한 연구 및 지원계획과 대규모 양산 계획을 담고 있다. ’09 년도에 신규 배아줄기세포 연구에 대한 규제를 폐지한 이후에 지속적으로 지원 강도를 높이고 있는 추세이다. 일본 또한 2014년 ‘재생의료등 안정성 확보법’을 시행하며 다수의 줄기세포치료제가 조기에 시장에 출시될 수 있도록 했고, 동시에 엄격한 사후관리를 하며 위험도를 줄이고 있다. 우리나라도 2016 년 10 월에 ‘국립줄기세포재생센터’를 개소한 것을 비롯해 정부 차원의 연구비 지원과 제도적 혜택 을 증가시키고 있는 것으로 파악된다. 줄기세포치료제 시장은 퇴행성질환을 겪는 환자 들이 늘어나면서 계속 성장할 것이며, 이에 따라 각국의 경쟁강도도 더욱 높아질 것으 로 전망된다.
세계 최초의 ALS(루게릭병) 줄기세포치료제 ‘뉴로나타-알’
‘뉴로나타-알’은 세계 최초의 ALS 줄기세포치료제이며 국내에서 4번째로 판매 허가된 줄기세포치료제이다. 기존 연구결과에 따르면 ALS(루게릭병)는 뇌와 척수의 운동신경 세포만 선택적으로 사멸하는 퇴행성신경질환으로서 감각신경은 유지되면서 사지마비, 호흡마비로 진행되고 발병 후 2~5년내 보조 호흡상태에 이르거나 사망하게 되는 희귀 난치성 질환이다. 또, ALS의 유병률은 인구 10만명당 2~3명정도로 시장규모는 한국 의 경우 2,500 명(심평원 질환별 통계자료의 운동뉴런질환<질병코드 G122> 2013 년 환자수 2,734 명의 90%를 ALS 환자로 추정)정도 이고, 세계적으로는 35 만명 정도로 추정된다.
현재 ALS 를 대상으로 품목허가를 받아 시판되고 있는 치료제는 사노피의 ‘리루텍(성 분명 Riluzole)’과 코아스템의 ‘뉴로나타-알’, 그리고 지난 5월 미국 FDA의 승인을 받 은 일본 미쓰비시다나베파마의 ‘라디컷(성분명 에디라본)’이 있다. 가장 보편적으로 판 매되고 있는 ‘리루졸’은 2~3 개월의 수명연장 효과만 입증되어 있는 상태이고 간독성, 무력성 및 경직 악화 등 치명적인 부작용이 있는 것으로 알려져 있어 치료제로써 환자 들에게 큰 신뢰를 받지 못하고 있는 것으로 추정된다. ‘에다라본’은 지난 2001년 급성 뇌경색 치료제로 승인받은 후 2015 년에 ALS 에 대해 추가 적응증을 받았다. ‘에다라 본’은 뇌허혈시 발생하는 자유래디칼(free radical)을 제거해 지질과 산화반응을 억제하 고 허혈 역 또는 그 주변의 신경세포를 보호하는 작용을 한다. 일반적으로 ALS 환자 들도 자유래디칼이 높아지기 때문에 ‘에다라본’이 투입되면 근력 저하와 근위축의 진행 을 억제하는 효과가 있다고 보고 있다. 하지만 아직 적용된 사례가 많지 않기 때문에 ‘에다라본’의 정확한 효능을 파악하기에는 상당한 시간이 걸릴 것으로 보인다.
‘뉴로나타-알’은 2 상 임상시험에서 시험약 투여후 약 4 개월동안 신경세포의 사멸 억 제, 항염증, 면역조절을 동시에 달성해 투여환자의 신체기능 저하 속도를 약 73%정도 감속시키는 효과를 나타냈고, 시험약 투여 후 약 6 개월후에도 신체기능 저하 속도를 약 50%이상 완화시키는 효과를 나타냈다. 이는 ALS 치료에 대한 상당히 주목할 만한 결과이다. 한편, ‘뉴로나타-알’에 대한 임상 3상 시험이 올해 12월부터 시작되어 2021 년까지 예정되어 있어 그 결과에 귀추가 주목된다.
한양대병원의 루게릭클리닉은 ‘뉴로나타-알’ 개발에 공동연구한 병원으로써 ’15 년 2 월 첫 환자투여를 시작한 이래로 ’17년 3분기까지 150명 정도의 환자에게 투여한 것 으로 추정된다. ‘뉴로나타-알’의 시술은 골수채취와 치료제를 2 회에 걸쳐 뇌척수강내 주사로 투여하는 것으로 이루어진다. 즉, 의사가 처방을 하면, 환자로부터 채취한 줄기 세포를 한달간 배양해 치료제를 생산하여 해당환자에게 뇌척수강내주사로 투여(1회차) 하고, 다시 한달 후에 한번 더 뇌척수강내주사로 투여(2회차)하는 것이다. 이러한 One Cycle(‘골수채취+치료제 2회투여’)의 시술에 상당히 높은 비용이 소요되며, 환자 치료비는 약 6,000 만원에 이른다. 이처럼 높은 완제의약품 가격은 결국 투여환자에게 큰 부담으로 작용하고 있고, 회사의 매출성장에도 제약요인으로 판단된다. 결국 환자는 물 론이고 동사 입장에서도 ‘뉴로나타-알’에 대한 건강보험 급여 적용이 절실한 상황으로 보인다. 만약 ‘뉴로나타-알’에 대한 건강보험 급여적용이 된다면 환자 치료비는 기존 금액의 10% 수준인 600 만원으로 줄어들기 때문에 신규 투여 및 반복 투여 환자수가 늘어날 수 있을 것으로 전망된다. 국내에서는 안트로젠의 큐피스템(크론성누공, 자가지 방유래중간엽줄기세포)이 ’14 년 1 월 줄기세포치료제로써는 최초로 보험급여 등재를 이룬 적이 있다.
참고로, 한양대병원 루게릭클리닉은 앞서 언급한 김승현교수가 센터장으로 있는 클리 닉으로써 루게릭병관련 등록환자가 1,000 명 이상되는 국내 최초이자 최대 규모의 권 위있는 루게릭클리닉이다.
투자포인트
① 해외 환자의 급격한 유입 증대
’17년 하반기 들어 해외환자가 급격히 증가하고 있는 것으로 추정된다. ’15년 판매개 시후 ’16년까지 해외환자는 매년 5명 미만에 불과했으나 올해는 연말까지 20명에 육 박할 것으로 보이고 국내환자를 포함한 전체환자수도 증가추세로 있는 것으로 추정된 다. 10만명 중 2~3명정도 걸리는 희귀질환임을 감안시 해외 의사와 환자들의 관심이 상당히 빠르게 증가하고 있다는 판단이다. 특히, ‘뉴로나타-알’ 시술을 받으려면 각 1 개월 간격으로 3회에 걸쳐 보호자와 함께 한국을 방문해야 하는 번거로움이 있고 치료 비와 경비가 크다는 점을 고려할 때 ‘뉴로나타-알’에 거는 기대가 상당하다는 생각이다.
그렇다면 해외에서는 ‘뉴로나타-알’에 대해서 어떤 채널로 접하고 한국의 한양대병원 까지 찾아오는 강행군을 결심하게 될까?
여러 채널로 ‘뉴로나타-알’에 대해 알 수 있겠지만, 그 중에서도 한양대학교 김승현 교 수가 관련분야 최고 권위의 학회인 ‘국제 ALS/MND학회’에서 지난 2년간 매년 연말 ‘뉴로나타-알’ 연구결과에 대해 발표한 것이 주요했다는 판단이다. 신경과 관련 세계적 인 석학들이 모인 포럼에서 ALS 에 대한 유효한 치료제가 거의 없다시피한 상황에서 신체기능 저하속도를 현저히 완화시키는 ‘뉴로나타-알’은 상당한 주목을 받았다.
또, 주목해야 할 부분이 있다. 과연 ‘해외 어느 병원의 어떤 의사가 환자를 보냈나?’라 는 점이다. 올해들어 미국의 MGH(Massachusetts General Hospital)에서 보낸 환자수 는 전체 해외환자의 50%가 넘는것으로 추정된다. MGH는 미국 하버드의대(Harvard Medical School)의 교육을 담당하는 병원 중 가장 큰 병원이다. MGH 의 ALS 센터 Director가 자신의 환자를 보내고 있다. 그녀는 하버드의대의 신경과 교수이기도 하며 최근 미국에서 수행되는 주목받는 ALS 치료제의 3 상 임상시험 책임자를 맡고 있다. 또, Houston Methodist의 ALS/MND Clinic의 Director인 Appel 교수의 추천을 받 고 온 환자도 있다. Dr. Appel은 ALS연구 관련 세계 최고의 권위자이며, 우리가 잘 알 고 있는 ‘Ice Bucket Challenge’의 창시자이다. 한양대의 김승현 교수도 Appel의 Clinic 에서 수학한 경력이 있다. 이와 같이 ALS 관련 세계적인 권위자들이 ‘뉴로나타-알’에 대한 지대한 관심으로 자신의 환자들을 보내는 점은 치료제로써의 ‘뉴로나타-알’의 높 은 가능성에 대한 반증으로 판단한다.
② ’18년말 ‘뉴로나타-알’ FDA품목허가 가능성 높다
동사는 내년 2월부터 미국 FDA측과 BLA(Biologics License Application)접수를 위한 미팅이 예정되어 있다. 약 3~4개월 정도 소요될 것으로 예상되는 Pre-BLA미팅을 통 해 BLA접수 여부가 결정될 것이다. 만약, BLA접수가 된다면 6개월 가량의 검토기간 을 거쳐 품목허가 여부가 결정나게 된다. 만약 BLA 접수가 된다면 유력한 ALS치료제 가 희소한 상황을 감안시 FDA허가 가능성이 높다는 판단이다. 그 이유는 다음과 같다.
지난 10 월 미국 FDA 는 재생의료 분야의 세포치료제 품목허가에 대해서는 ‘Fast – Track’을 적용시키겠다는 내용을 발표했다. 이는 치료가 절실한 환자들에게 보다 빠르 게 재생의료를 받을 수 있는 길을 열어주겠다는 의지와 재생의료에 대한 적극적인 지 원을 의미한다. 올해들어 미국 FDA가 각종 신약승인 규제를 대폭 완화하는 추세로 가 고 있는데, 재생의료 및 세포치료제에 대해서도 동일한 정책을 펼친다는 생각이다. 따 라서 한국의 임상2상에서 뚜렷한 치료효과를 보고, 품목허가를 받은 ‘뉴로나타-알’ 의 경우 FDA허가 가능성이 높다는 판단이다. 이 점에 대해서 그동안 미국 FDA가 품 목허가에 대해 매우 엄격한 기준을 적용했기 때문에, ‘어떻게 미국에서 임상 3상도 거 치지 않고 허가를 받을 수 있는가?’ 라고 추가적인 의문을 제기할 수 있다. 하지만 이 미 지난 5월 일본의 ‘에다라본’이 기존의 경우와 달리 예외적인 절차를 거치며 승인받 은 바 있다. 일본에서만 모든 임상시험을 실시했고, 품목허가를 받은 ‘에다라본’은 미국 에서 추가적인 임상시험없이 FDA 승인을 받았다. 이러한 대목에서 ‘뉴로나타-알’의 FDA 허가 가능성을 엿볼 수 있다. 추가적으로 앞에서 언급했듯이 미국의 MGH 등에 서 보내는 다수의 환자들이 치료를 위해 많은 시간과 고비용을 들여 한국까지 와야된 다는 점이 FDA입장에서는 부담이 될 수 있다.
한편, 동사에서는 김연희 본부장의 총책임하에 FDA 허가관련 준비를 하고 있다. 김연 희 전무는 동사의 총괄기획본부장으로써 그 이력이 화려하다. 한국계 미국인으로써 미 국 미시간대학에서 바이오엔지니어링 석사학위를 받았고, 동경대에서 화학&생명과학 부문 박사를 취득한 후 미국 라이스대학교에서 기술경전문가 MBA 를 취득한 재원 이다. 특히, 김연희 전무의 많은 이력중에서도 세계적인 암센터를 자랑하는 미국의 앰 디앤더슨(MD Anderson) 병원의 신약개발 및 기술이전 센터에서 ’08 년부터 3 년간 Assistant Professor로 재직한 경력에 주목한다. FDA 허가를 준비하는 과정과 허가 이 후 현지 파트너 발굴 및 기술이전 업무에서 관련업무 경험과 인적 Network를 보유한 김본부장이 상당한 기여를 할 수 있을 것이라는 예상이다. 더불어 동사는 바이오 기술 특례로 상장된 기업이지만, 연구개발 뿐만 아니라 보유기술의 Sales에도 상당한 역량을 갖추고 있는, 다시말해 안팎으로 균형감을 갖춘 기업이라는 판단이다.
③ 국내 건강보험 급여 등재 추진
국내에서 ‘뉴로나타-알’의 처방이 확대되기 위해서는 건강보험 약가등재가 필요하다. ‘뉴로나타-알’로 치료받을시에 환자 본인부담금은 6,000만원 수준이다. 건강보험이 적 용되면 환자치료비가 원래 부담금의 10% 수준인 600만원 수준으로 낮아진다. ’16년 한해동안 ‘뉴로나타-알’ 치료를 받은 환자가 30 명 정도이고, 국내 예상 환자수가 2,500 명이라는 점을 감안하면 건강보험 적용시에 신규치료 및 반복치료 수요가 급증 할 가능성이 높다. 올해안에 건강보험심사평가원과 보험 약가등재에 대한 논의가 시작 될 예정이다. ‘약가’를 얼마로 정하느냐에 대한 열띤 논의가 이루어질 것이며, 보험적용 의 최종 결정시점까지 약 18개월 정도의 시간이 소요될 것으로 보인다. 보험에 등재되 는 최종 약가는 국내에서의 매출은 물론이고, 향후 해외에서 상용화를 이룬 뒤 기술이 전 가격에도 상당한 향을 미칠 것으로 예상되기에 귀추가 주목된다.
④ 비임상 CRO업체인 켐온 보유로 사업 안정성 확보
동사는 ’13년 자회사 켐온을 인수(지분 54.27%)하다. 켐온은 국내 민간 최초의 비임 상CRO(Contract Research Organization)업체로서 ‘안정성평가연구소’, ‘바이오톡스텍’ 과 함께 국내 Top3 비임상시험기관이다. (참고로, 비임상CRO 란 신약개발시에 전임 상단계에서 동물실험을 통해 독성(안정성)과 약효(유효성)를 사전 검증하는 시험을 말 한다) 최근 ‘화평법(화학물질의 등록 및 평가에 관한 법률)’의 확대추세에 따라 비임상 CRO업체들이 주목받고 있다. 산업 현장의 안전도를 높이기 위해 기업이 취급하는 모 든 신규 화학물질과 연간 1t 이상 제조·수입·판매하는 기존 화학물질 등 510종을 매년 정부에 등록하도록 한 것이 ‘화평법’ 법의 핵심내용이다. 뿐만 아니라, 최근 환경부는 등록 대상 물질을 현재 510종에서 무려 7,000여종으로 늘리고 미등록 등 위반 과징금 도 신설하는 내용의 화평법 개정안을 입법예고 했다. 비임상CRO사업은 각 평가기관 의 GLP(Good Laboratory Practice)인증을 필수적으로 받아야 하는 등 진입장벽이 상 당히 높은 사업이기에 ‘화평법’ 실행 및 확대적용에 따른 직접적인 수혜가 가능하다는 판단이다.
일반적으로 제약회사나 동사와 같은 바이오 의약품 개발 기업들은 해당 의약품을 초기 연구부터 상용화까지 상당한 시간이 소요된다. 동사의 경우에도 ‘뉴로나타-알’의 연구 및 상용화에 10 년 이상의 시간이 소요되었고, 현재 ‘뉴로나타-알’이라는 단일품목에 의존한 매출이 발생하고 있다. 켐온은 그동안 지속적인 매출 증가를 보이며 안정적인 성장을 하면서 동사의 재무적 안정성을 높이는데 기여했고, 향후에는 동사의 주요한 성 장 모멘텀이 될 가능성이 높아 보인다.
⑤ ‘뉴로나타-알’외 다수의 난치성질환 관련 파이프라인 보유
동사는 루게릭병 치료제인 ‘뉴로나타-알’외에도 루푸스(SLE : Systemic Lupus Erythem atosus), 무산소성 뇌손상(ABI : Anoxic Brain Injury), 다계통위축증(MSA), 내화성간질 (Refractory Epilepsy), 골관절염 등 다양한 질환의 파이프라인을 보유하고 있다. 그중 루푸스/무산소성뇌손상/다계통위축증은 임상1상 및 연구자임상 1상이 진행중에 있다. 특히, 지난해 6월 한림제약으로 국내 License-Out에 성공한 루프스의 경우 ’18년 상 반기에는 임상 1 상이 완료될 예정이다. 참고로, 루푸스 또한 희귀질환으로 국내에 약 23,000명의 환자가 있는 것으로 추정되며, 발병원인에 대해 정확히 밝혀진 바가 없다. 현재 글로벌 제약업체인 GSK의 ‘벤리스타’가 미국에서 품목허가를 받았으나 국내에서 는 아직 시판되지 않았기에 적합한 치료제가 전무한 상황이다. 그 밖의 다른 치료제도 지속적으로 연구중에 있으며 연이어 임상 1 상 결과가 발표될 예정이다. 특히, 동사는 치료제 개발시 임상센터와 의료진이 연구 초기부터 공동연구를 수행하기 때문에 치료 제 개발 후 상용화까지 소요되는 시간이 상대적으로 짧은 점도 긍정적으로 보인다.
실적전망 및 밸류에이션
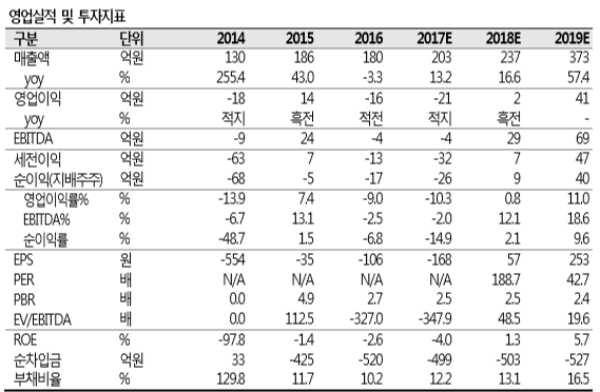
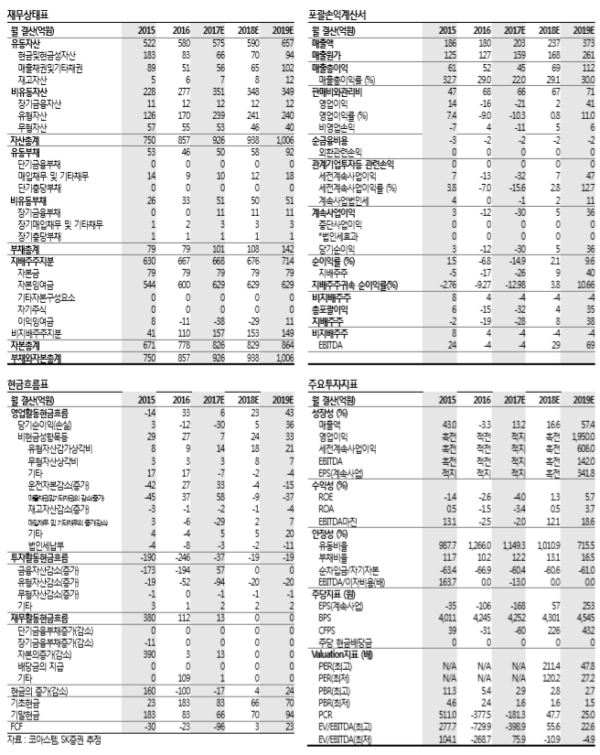
’17년 실적은 매출액 203억원, 업이익 -21억원으로 전년과 비슷한 수준을 기록할 것으로 예상한다. ’18년도에는 ‘뉴로나타-알’의 판매 증가와 화평법 시행의 수혜를 받 을 것으로 예상되는 켐온의 성장으로 실적기준 소폭 성장(매출액 기준 +15%)이 가능 할 것으로 보인다. 본격적인 성장은 건강보험 약가 등재 및 미국 FDA의 승인이 맞물 려 있는 ’19년부터 가능할 것으로 전망한다.
투자의견 매수, 목표주가 15,000원을 제시하고 신규 편입한다. 목표주가는 SOTP밸류 에이션을 사용하여 산출했다. 동사의 주된 매출 품목인 ‘뉴로나타-알’의 가치는 국내 건강보험 약가 등재(’19 년 상반기 예상) 및 미국 FDA 승인(’18 년말 예상)을 감안해 향후 10년간 발생할 것으로 보이는 Cash Flow를 DCF법으로 계산했으며, 그 가치는 약 1조 900억원으로 추정된다. 하지만, 보험약가 등재 및 미국 FDA 승인 여부 등의 불확실성을 감안하여 보수적인 관점에서 할인율을 85% 적용했다. 자회사 켐온의 가치 는 현재 시가총액에 지분율을 곱하여 산출했으며, 보수적인 관점에서 할인율을 30% 적용했다. <자료제공:SK증권>
 |
박병우 기자 bwpark0918@pharmstock.co.kr