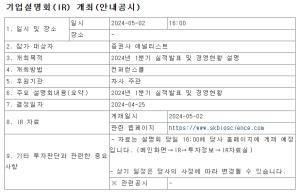
네이처셀은 지난 16일 식품의약품안전처로부터 조인트스템의 조건부품목허가에 반려처분 통지를 받았다며 이의신청등 대응방안을 모색하고 있다고 밝혔다.
네이처셀은 홈페이지를 통해 “조인트스템의 임상이 실패한 것이 아니라 국내 3상 조건부 품목허가 요건에 부합하지 않는다는 중앙약심위의 의견이며 규제 완화의 입법 취지와 맞지 않는다 ”며 “식약처 실무부서와의 회의를 거친 후, 이의신청 절차 등 향후 대응방향에 대해 이번주내로 결정하겠다”고 밝혔다.
식품의약품안전처 중앙약사심의위원회는 16일 조인트스템의 미국 임상2상 계획이 조건부 허가상 필요한 치료적 확증시험과 유사하지 않다며 네이처셀에 통보했다.
네이처셀은 이에대해 조인트스템 미국 임상2상은 무작위, 대조, 이중눈가림으로 진행되어 치료적 확증시험과 유사하며 다만, 결과 분석의 경우 대조군이 미국에서 허가받은 치료제인 Synvisc-One으로서 6개월 후의 비교는 통계적으로 유의적인 차이를 보일 수 없으므로 애초에 대조군과의 비교가 아닌 투여군에서 전후 비교로 통계적 유의성을 검증 하였다“며 ”임상계획이 조건부 품목허가에 부합하지 않는다는 의견은 맞지 않다고 생각한다“고 밝혔다.
또 효과가 낮다는 일부 위원의 지적에 대해 네이처셀이 제출한 모든 자료를 검토하지 않았기때문이라고 덧붙였다.
한국과 미국에서 세 차례에 걸쳐 5개 병원에서의 임상 결과 모두 일관적인 경향으로서 좋은 효과가 확인 되었고 1차 효과지표인 WOMAC과 VAS 모두 90% 정도의 환자에서 치료성공율을 보였다는 것.
또한, 조인트스템 투여 6개월 후 MRI상으로 46.15% 환자의 연골이 재생되었고, 1년 뒤에는 60% 이상 환자들의 연골이 재생되는 매우 의미 있는 결과를 나타났는데 이 결과는 중증퇴행성 관절염의 근본적인 구조적 개선 가능성을 의미하는 것이라고 주장했다.
네이처셀은 충분한 심의가 이루어지도록 하기 위해 사전 정식 신청을 통해 의견진술의 기회를 요청하였지만 이루어지지 않았다고 강조했다.
김사랑 기자 kimsarang0420