- 진행성 고형암환자대상, 임상 2상시험 권장용량 결정
 |
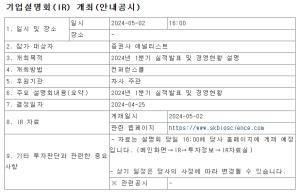
신약개발 기업인 오스코텍(039200)은 식품의약품안전처로부터 항암제인 AXL 저해제 'SKI-G-801'의 임상 1상 시험계획(IND)을 승인받았다고 30일 밝혔다.
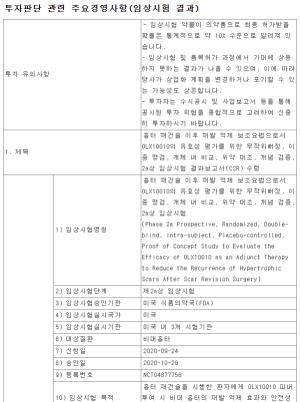
오스코텍의 SKI-G-801은 AXL 키나아제(인산화효소)를 선택적으로 저해하여 암의 전이를 막고 종양미세환경에서 항암 면역반응을 활성화하는 고형암치료제 후보물질이다.
연세대학교 의대 조병철 교수팀과 공동 연구를 통해 확인된 우수한 항종양 및 전이 억제 효능과 기존 면역항암제와 병용투여 시 항종양 효능의 개선을 입증한 데이터는 최근 3년간 미국암연구학회 연례학술회의(AACR)에서 발표된 바 있다.
AXL저해제 SKI-G-801의 임상 1상은 국내 연대세브란스병원, 서울아산병원, 삼성서울병원 등에서 약 30~40명의 비소세포폐암, 삼중음성유방암, 신장암, 두경부암 등의 환자들에게 경구투여로 진행될 예정이다. 이번 1상은 올해 4분기 중 첫 환자 투약이 가능할 것이라고 회사측은 설명했다.
오스코텍 김중호 연구소장은 “임상 1상을 위한 IND 신청이 식약처의 공식 승인을 받게 된 것을 기쁘게 생각하고, 당사의 FLT3/AXL 이중저해제 SKI-G-801은 주사제형으로, 진행된 급성 골수성 백혈병 환자 대상 글로벌 임상 1상을 통해 높은 안전역을 확보했으므로 임상 기간이 단축될 것"이라 말했다.
이어 "그동안 다양한 동물모델, PDX모델, 화학항암제 병용투여 모델 등에서 종양미세환경 내 항종양 면역세포 증가와 항원 제시 활성화를 통한 우수한 항종양 효능 등을 입증했으므로 실제 환자 대상 임상 1상에서도 긍정적인 안전성과 효능이 기대된다”고 전했다.
김사랑 기자 kimsarang0420