|
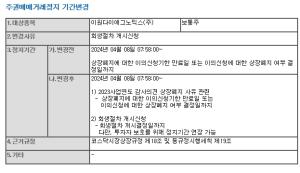
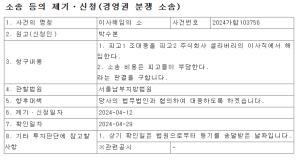
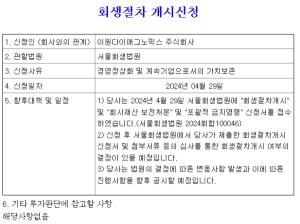
크레오에스지(사명 변경 전 큐로컴)는 자회사 이뮤노백스바이오(사명변경 전 스마젠)가 개발 중인 에이즈 백신 ‘SAV001’ 연구개발이 순조롭게 진행되고 있다고 11일 밝혔다.
이뮤노백스바이오는 에이즈 백신 임상 2상 관련 대부분의 사전절차는 완료한 상황으로, 대규모 백신 시료 생산 후 FDA에 2상 임상시험계획(IND)을 신청할 방침이다.
회사 측에 따르면 개발 중인 SAV001은 에이즈 치료 및 예방이 가능한 세계 유일 ‘전체 사독 에이즈 백신’이다. 바이러스 전체를 항원으로 사용하기 때문에 예방 효과가 우수하지만, 기술 난이도 및 미국 FDA 승인 기준이 높다. 에이즈는 고위험군 병원체로 엄격한 기준을 충족한 시설에서만 백신 생산이 가능하다.
특히 임상 2상은 1상보다 생산 시료의 품질, 분석법 등에 대한 FDA 허가 절차가 까다롭다. 이뮤노백스바이오는 지난 2017년 임상 1상을 마치고 FDA와 후속 개발 과정 관련 논의까지 완료했으나, 코로나19 발생으로 위탁생산업체들이 일제히 코로나19 백신 제조에 나서면서 에이즈 백신 시료 생산이 중단됐다. 이뮤노백스바이오는 임상 2상용 백신 시료 생산을 위한 준비 절차를 마무리한 후 본격적인 에이즈 백신 개발에 나설 예정이다.
이뮤노백스바이오는 SAV001 미국 임상 1상 시험에서 백신의 효능과 안전성에 대한 검증을 마쳤다. 임상 과정에서 에이즈 예방에 중요한 기능을 하는 중화항체가 체내에서 형성되는 것을 확인했고, 화학적 처리와 방사선 처리를 모두 거쳐 부작용도 나타나지 않았으며, 임상 1상 진행 후 백신 대량생산 공정을 구축하고 FDA 동의도 얻었기 때문에 임상 2상에 신속히 진입할 수 있을 것이라고 회사 측은 설명했다.
회사 관계자는 “코로나19로 에이즈 백신 개발이 지연됐으나, 엔데믹 후 임상용 백신 시료 생산시설 확보에 박차를 가해 관련 준비가 마무리 단계에 진입했다”며 “ SAV001은 기존 인간면역결핍바이러스(HIV) 일부분만 사용한 에이즈 백신과 달리 전체 사독 에이즈 백신으로 예방 효과가 뛰어난 것이 장점”이라고 강조했다.
글로벌 시장조사기관 ‘360iResearch LLP’에 따르면 글로벌 에이즈 백신 시장 규모는 지난해 6억 7783만달러(약 1조원)에서 연평균 40%씩 성장해 오는 2030년 70억 1184만달러(약 9.6조원)까지 확대될 것으로 전망된다. 전 세계 에이즈 감염 환자는 지난 2022년 기준 약 3900만명(세계보건기구)에 달하는 것으로 알려졌다.
박병우 기자 bwpark0918@pharmstock.co.kr