회사개요
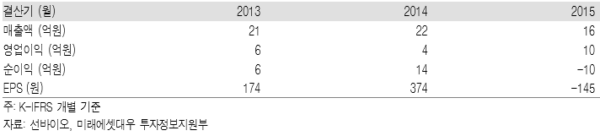
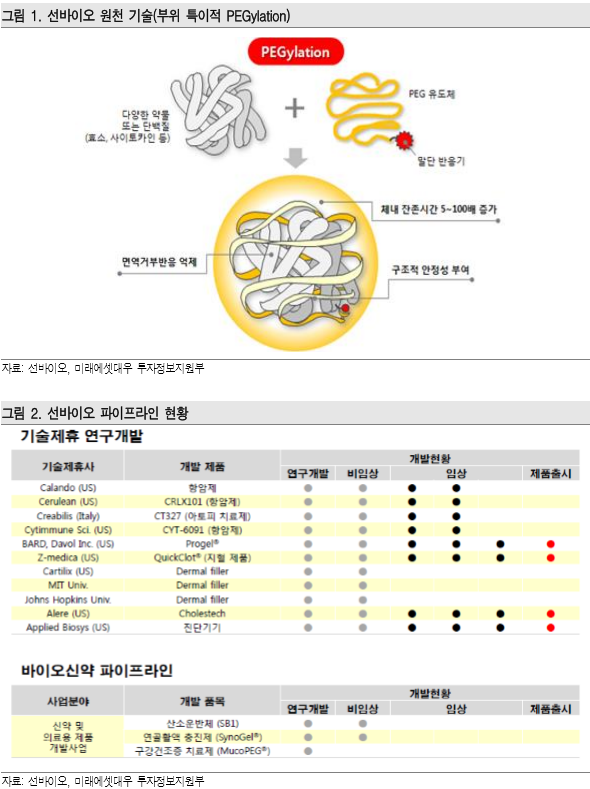
선바이오는 1997년 설립된 신약개발 기업으로 바이오신약 및 바이오시밀러에 적용되는 플랫폼 기술인 부위 특이적 PEGylation에 대한 원천 기술을 보유하고 있다. 다양한 고객사에 동사 플랫폼 기술을 제공 중이며 항암제, 필러, 진단 등 폭넓은 제품에 응용되고 있다는 점이 특징적이다.
동사 기술이 적용된 바이오시밀러 NEUPEGTM, 미국품목 심사 확인 중
자체 신약 파이프라인으로는 산소운반체(비임상), 연골활액 충진제(비임상), 구강건조증(후보물질 연구) 치료제를 보유하고 있다. 바이오시밀러 파이프라인은 NEUPEGTM과 PEG-INF이 인도 Intas사와 공동 개발 중에 있다.
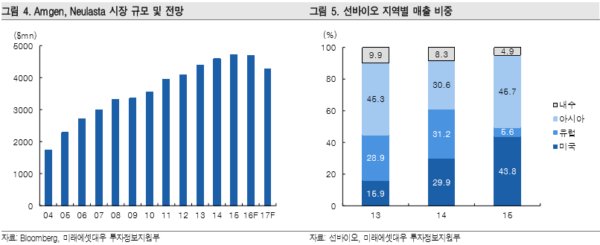
선바이오의 기술이 적용된 바이오시밀러 제품은 NEUPEGTM이며 단기적으로 기업가치에 가장 중요한 기여를 할 것으로 예상되는 제품이다. NEUPEGTM은 Intas사를 통해 인도에서 이미 상용 화된 제품으로써 항암 치료 환자의 백혈구 생성을 촉진시켜 감염을 방지해주는 G-CSF(Amgen사, Neupogen)의 개량신약인 Pegylated G-CSF(Amgen사, 제품명 Neulasta)의 복제약이다. NEUPEGTM가 타겟하는 전 세계 시장 규모는 약 5조원이다.
Intas사는 NEUPEGTM의 선진시장 진출 파트너로 캐나다 제약사 Apotex와 협력하고 있다. Apotex는 2014년 12월에 NEUPEGTM의 미국 FDA에 허가 신청을 완료한 상태이며, 미국 시장 을 두고 Amgen과 진행한 특허 소송(patent dance)에서 2016년 9월 승소한 상태이다. NEUPEGTM은 경쟁 제품 대비 가장 빠른 상업화 단계에 있는 것으로 판단된다.
NEUPEGTM의 허가 이후 점진적 매출증대 전망
NEUPEGTM가 상업화 될 경우 선바이오로 직결되는 실적은 Apotex의 NEUPEGTM매출액 가운데 약 1.5%~2.5% 수준이 될 전망이다. NEUPEGTM의 FDA 품목허가 시점은 2017년 하반기로 예상된다. 유럽 시장은 오리지널 특허가 만료되는 2017년에 판매허가 신청이 이루어질 예정이다. 따라서 허가 이후 미국과 유럽 시장 출시 예상 시점은 2018년이며, NEUPEGTM 판매로 인해 선 바이오는 연간 100억원 이상의 러닝 로열티 수입이 가능해질 전망이다.
NEUPEGTM의 품목 승인 이후 미국 및 유럽 시장 점유율 확대에 대해 낙관적인 전망이 가능하다. 그 이유는 유사 제품의 시장 침투가 빠른 속도로 이루어졌기 때문이다. 사례로 Neupogen의 바이오시밀러는 유럽시장에 출시된 후 5년만에 40%이상 시장 침투가 이루어졌다. 미국에 출시된 Neupogen의 바이오시밀러 Zarzio(산도즈사 제품)는 미국의 바이오시밀러 인센티브 정책에 힘입어 출시한지 4개월만에 오리지널 제품의 24% 시장을 장악했다. <자료제공 : 미래에셋대우>
 |
 |
 |
 |
조병욱 기자 bucho85@pharmstock.co.kr






