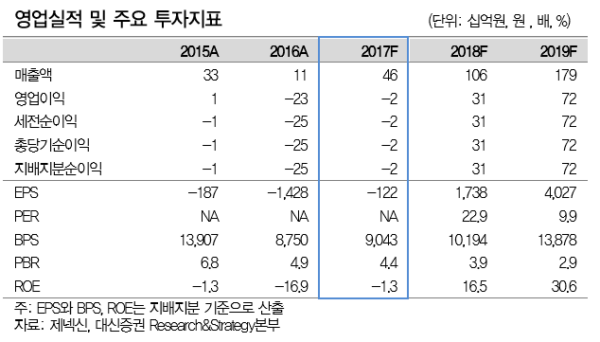
투자의견 매수, 목표주가 59,000원(상승여력 48%)으로 커버리지 개시
- 목표주가 59,000원은 주요 파이프라인의 위험조정 순현재가치 (riskadjusted NPV, rNPV)를 합산, 잔여이익모델 (Residual Income Model, RIM)을 통해 산출
- 주력 파이프라인 임상 순항 중. GX-H9(성장호르몬 치료제), 9월 임상2상 중 간결과 발표, GX-188E(자궁경부암 치료제) 1H18 임상2b상 결과 발표 예정
- 글로벌 제약사(Merck)와의 협업 및 경쟁력 있는 파이프라인을 다수 보유한 점을 긍정적으로 판단.
GX-H9: 높은 시장성 + 월 2회 제형의 Best-in-class 경쟁력
- 성장호르몬 치료제 시장은 $3.0-3.5 bn 규모(소아 시장>70%)이며 지속형 치료제 개발 시 시장 규모는 더 커질 것으로 전망
- 당사 지속형 플랫폼 기술 Hybrid Fc을 적용하여 안전성 및 지속성 우위로 소아 시장에 대한 경쟁력 보유. 최대 월 2회 투여 제품으로 개발 가능한 Best-in-class 경쟁력 소아 임상 6개월 효능 결과 올 9월 미국 소아내분비학회에서 발표 예정
GX-188E: 높은 완치율 + Keytruda 병용요법으로 가치 업그레이드
- 현재 자궁경부(전)암에 대한 치료제 없는 상황. GX-188E는 DNA 치료 백신 으로 경쟁약물에 비해 자궁경부전암에서 높은 완치율의 임상 데이터 보유
- Merck의 Keytruda 병용요법으로 기술력 입증 + 자궁경부암 적응증 확대로 가치 업그레이드
- 1H18 임상 2b상 결과 발표 예정. 임상 2a상 대비 마일드한 병변에 대해 테 스트 진행. 긍정적 결과 기대
 |
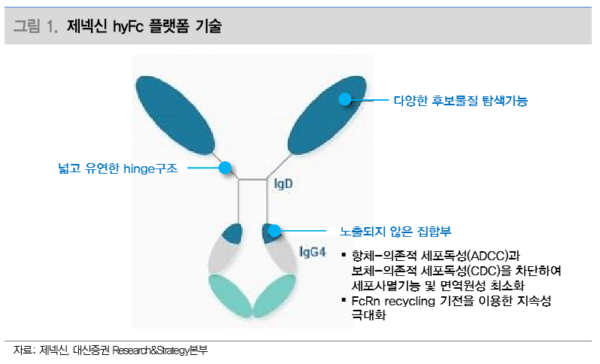
제넥신 핵심 플랫폼 기술: 항체 융합 단백질(Hybrid Fc)
최근 바이오의약품 개발 트렌드 중 하나는 지속형 의약품이다. 대표적인 지속형 기술에 는 PEGylation, glycosylation, 항체 융합 기술(Fc Fusion) 등이 있다. 대부분 혈중 반감기 를 증가시킴으로써 약물 투여간격을 줄여 환자의 편의성을 증대시키는 것에 목적을 두고 있다. 특히 성장호르몬, 인슐린, EPO(Erythropoietin), G-CSF 등 단백질 치료제는 효능, 안정성 및 편의성 측면에서 미충족 수요가 많아 지속형 의약품 개발이 활발하다.
Amgen은 glycosylation 기술을 적용하여 주 1회 제형의 지속형 2세대 EPO 인 Aranesp 를 개발했다. Aranesp는 1세대 EPO인 Epogen(주 3회 투여)를 대체하며 2001년 60억 달러의 EPO 시장을 2010년도에 120억 달러로 확대했다.
한편 항체 융합기술은 특정 항체(Immunoglobulin G, IgG)의 Fc 단편을 이용하여 약물의 반감기를 늘리는 기술이다. Fc에는 FcRn(Fc Recycling) 결합부위가 존재하며, FcRn 결합 부위가 있는 항체의 체내 반감기는 평균 3주로, 결합부위가 없는 단백질의 반감기인 2~3시간 대비 길다. 따라서 원하는 약물(단백질)과 항체의 Fc 단편을 연결하면 약물의 반감기를 증가시킬 수 있다. 현재 Enbrel, Orencia, Amevive 등 다양한 지속형 의약품에 사용되고 있다. 그러나 항체 융합 기술은 Fc 단편의 고유기능에 의한 세포독성 문제가 발생하며, 약물과 Fc 단편 간 연결부위의 공간적인 제약으로 인해 약물의 활성이 저해되 는 문제가 발생한다.
제넥신은 기존 항체 융합 기술을 개선하여 항체 융합 단백질(Hybrid Fc, hyFc) 플랫폼 기술을 확립했다. 이 플랫폼 기술은 호르몬, 펩타이드, 사이토카인 등 다양한 약물 후보 군에 적용이 가능하며, IgG항체와 IgD항체를 융합하는 방법으로 기존 문제를 개선시켰 다. FcRn결합부위가 존재하는 IgG4 항체로 반감기를 증가시켰으며, IgD항체로 세포독성 문제와 약물 활성 저하 문제를 개선했다. IgD항체는 세포독성 문제가 없으며, 유연한 접 합부 덕분에 공간적 상호간섭이 최소화되도록 디자인 하는 것이 가능해 약물의 높은 활 성 유지가 가능하다.
 |
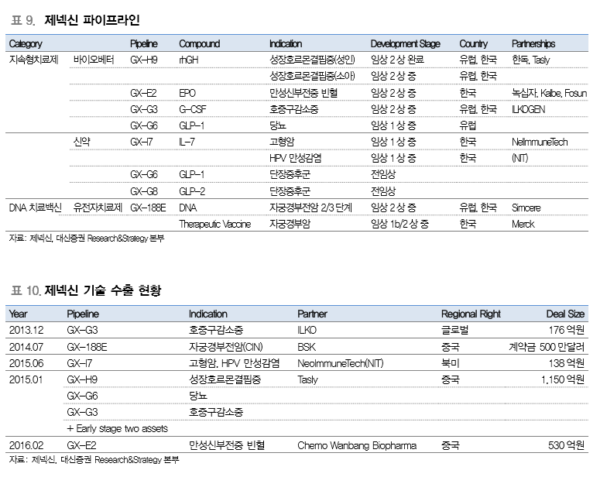
제넥신은 hyFc 플랫폼 기술과 고생산 세포주 제조 및 공정개발에 대한 노하우를 바탕으 로 체내 반감기 및 효능을 증가시킨 차세대 의약품을 개발하고 있다. 현재 개발중인 의 약품은 주로 암, 내분기계 질환, 면역계통 질환 등의 만성질환을 대상으로 한다. 대표적 파이프라인으로는 지속형 인간성장호르몬 (GX-H9), 빈혈 치료제 (GX-E2), 항암 면역 치료제 (GX-I7) 등이 있다.
아직까지 상업화 된 제품은 없으나 hyFc 기술이 적용된 다양한 파이프라인의 임상결과 가 안전성과 가능성을 뒷받침해주고 있다. hyFc 기술이 적용된 파이프라인 중 임상 진도 가 가장 빠른 파이프라인은 GX-H9이며 2021년에 상업화가 예상된다. 제넥신의 파이프 라인 다수가 hyFc 기반임을 감안할 때 hyFc 기술의 상업화 시 제넥신의 기업가치는 한 단계 업그레이드 될 것으로 예상한다.
4조 규모의 성장호르몬 시장, 앞으로도 더 성장할 전망
성장호르면 결핍증은 소아와 성인 모두에게서 발병
성장호르몬 결핍증(Growth hormone deficiency;GHD)은 내분비계 질환으로 뇌하수체 전엽이 담당하는 성장호르몬의 분비에 이상이 생겼을 때 발병한다. 성장호르몬 결핍시 소아 환자에서는 대표적으로 키 성장에 문제가 발생하며 성인 환자에서는 뼈성장과 근육 형성 저해 등의 이상 증세가 나타난다. 치료는 재조합 인간 성장호르몬 단백질을 1일 1 회 주사 투여 하는 방식으로 이루어진다.
기존 1세대 제품은 매일 주사 투여 필요
1세대 성장 호르몬 치료제 시장은 30~35억 달러 규모이며 미국, 유럽, 일본이 각각 1/3 정도의 점유율을 보이고 있다. 글로벌 제약사 위주의 시장으로 Pfizer사(Genotropin), Novo Nordisk사(Norditropin), Eli Lilly사(Humatrope), Genentech사(Nutropin), Merck사(Saizen)의 제품이 주로 사용되고 있다.
성장호르몬 시장의 70% 이상이 소아 대상. 지속형 치료제 니즈가 큼
하지만 1세대 치료제의 경우 연간 365번의 주사로 인한 통증 및 불편함이 투여 불이행 으로 이어져 치료 결과가 좋지 않다. 복약 순응도(처방에 따라 약물을 정확하게 복용하는 정도)가 높은 성인 환자도 3개월동안 최대 31번까지 투여를 불이행할 정도로 거부감이 커 지속형 제품에 대한 니즈가 크다. 또한 소아 환자에서 성장호르몬 투여 용량이 높아 전체 시장의 70% 이상이 소아환자 대상이기 때문에 주사 횟수를 감소시키는 지속형 치 료제의 니즈가 매우 큰 상황이다.
향후 2세대 치료제 도입시 시장 규모 더욱 커질 것
현재 개발중인 지속형 치료제는 투여횟수를 연간 365번에서 52번(주1회 제형) 또는 26 번(월2회 제형)으로 감소시켜 환자의 편의성을 크게 개선할 것으로 기대된다. 2세대 지속 형 성장호르몬은 1세대 대비 높은 약가가 예상되며, 향후 2세대 약물이 시장에 진입함에 따라 시장 규모는 더욱 커질 것으로 전망된다.
최대 월 2회 투여까지 가능한 GX-H9 의 Best-in-class경쟁력
제넥신은 hyFc기술을 적용하여 주 1회 및 월 2회 제형의 2세대 지속형 성장호르몬인 GX-H9을 개발하고 있다. GX-H9은 성인 임상 2상은 완료된 상태이며 현재 소아 임상 2상 진행 중에 있다.
현재까지 임상 결과를 통해 GX-H9은 대조군(Genotropin, 1일 1회 제형) 대비 67~100% 수준의 낮은 용량에서도 효능을 나타냈다. 또한 이상반응도 대조군과 비슷한 수준으로 관찰되어 GX-H9의 안전성과 내약성이 확인되었다.
소아 환자에 대한 임상 2상은 유럽 16개국과 한국을 포함한 총 17개국에서 진행 중이다. 올해 3월 말 소아 임상 2상 마지막 환자 최초 투여를 완료했으며, 총 2년간 효능을 확인 할 예정이다. 3개월 투여 결과를 기반으로 계산한 평균 키성장률은 대조군(Genotropin) 과 비슷한 결과를 보여 GX-H9의 비열등성을 입증했다. 1차 평가 항목인 6개월 투여 기 준 키성장률 결과는 올 9월 발표될 예정이다.
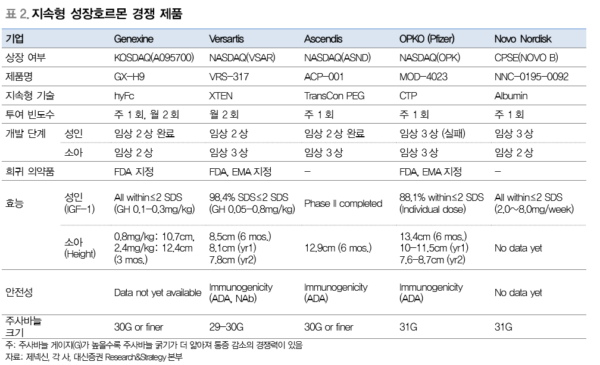
2세대 지속형 성장호르몬 개발 현황 (GX-H9 경쟁약물 분석)
2세대 지속형 성장호르몬: 주 1회 또는 월 2회 제형 개발 중
현재 다수의 글로벌 제약사에서 주 1회 또는 최대 월 2회 제형의 2세대 지속형 제품을 개발 중에 있다. 성장호르몬(somatropin) 자체는 50년 이상 임상에서 사용된 만큼 안전 성 이슈는 적은 편이다. 하지만 2세대 치료제는 제품마다 서로 다른 지속형 기술이 추가 적으로 도입되었기 때문에 이에 따른 안전성 검증이 특히 중요할 것으로 판단된다. 월 2 회 제형은 미국 Versartis사와 제넥신이 개발하고 있으며, OPKO사의 주 1회 제형이 가 장 먼저 시장에 진입할 것으로 예상된다.
월 2회 제형은 제넥신과 Versartis가 개발
Versartis사의 VRS-317은 XTEN 기술을 사용하여 친수성 폴리펩타이드를 약물과 융합 하여 체내 반감기를 증가시켰다. XTEN기술을 이용한 상업화 사례는 아직 없다. 현재 소 아 임상 3상이 진행 중이며 결과 발표는 올해 9월로 예정되어 있다. 성인 임상 3상은 올 해 말 시작될 예정이다. 2016년 9월, Teijin에 일본 상업화 권리를 1억 6500만달러에 이 전했다. 글로벌 성장호르몬 치료제 시장에서 일본의 규모가 약 1/3임을 감안할 때, VRS-317의 글로벌 가치는 약 4억 9500만달러로 추정할 수 있다.
Opko의 월 1회 제형이 임상 진행은 가장 빨라
OPKO사의 MOD-4023은 주 1회 제형으로 2세대 성장호르몬 치료제 중 시장에 가장 먼저 진입할 것으로 예상된다. OPKO는 체내 존재하는 호르몬의 일부인 C-terminal peptide(CTP)에 약물을 융합시켜 반감기를 늘리는 기술을 이용했다. CTP 기술은 Merck 의 Elonv(FSH-CTP)약물에도 사용되어 2010년 유럽에서 승인된 바 있다. OPKO는 성 인 임상 3상, 소아 임상 2상 단계에서 Pfizer와 글로벌 상업화 권리를 5억 7천만달러에 이전하는 계약을 체결했다.
 |
GX-H9: hyFc 기술의 안전성과 지속성 우위, 소아 시장에서 경쟁력 보유
제넥신의 GX-H9은 hyFc 기술의 안전성과 지속성 우위를 기반으로 특히 소아시장에서 경쟁력을 가질 것으로 판단된다. 주 1회, 또는 월 2회 제형으로 현재 소아 임상 2상 진행 중에 있다. 제넥신의 지속형 플랫폼인 hyFc가술은 아직 상업화 이전 단계이지만, 500명 이상의 환자에게 hyFc이 적용된 약물을 투여한 결과 현재까지 심각한 부작용 사례가 발 견되지 않아 안전성이 검증되고 있는 상황이다. 올 9월 IMPE학회에서 소아 임상 6개월 투여 효능데이터 발표가 예정되어 있다. 이번 임상을 통해 최대 월 2회 제형으로의 가능 성과 hyFc 기술의 안전성을 입증한다면, 글로벌 제약사와 기술이전 가능성이 더욱 높아 질 것으로 기대된다
 |
자궁경부암, 아직 치료제가 없다
자궁경부암: HPV 바이러스 감염으로 발생. 치료제는 없는 상황
자궁경부암은 자궁 경부 내 인유두종 바이러스(Human Papilloma Virus; HPV)의 감염으 로 발생되며 여성암 중 2번째로 높은 사망률을 보이는 질병이다. HPV 감염은 대부분의 경우 증상이 없거나 자연적으로 치유되지만 고위험군인 HPV에 감염될 경우 세포의 변 형이 유도되며 결국에는 자궁경부전암(Cervical Intraepithelial Neoplasia; CIN)을 거쳐 자궁경부암으로 발전하게 된다. 현재까지 알려진 100여 종의 HPV 바이러스 중 고위험 군인 16, 18 타입의 바이러스가 발병원인의 70% 이상을 차지하는 것으로 보고되었다.
아직까지 HPV 바이러스 감염으로 발생한 암의 치료제는 없는 상황이며 기존의 예방백 신은 이미 바이러스에 감염된 환자에게는 효과가 없다. 따라서 수술적으로 자궁경부 감 염부위를 제거해야 하며 수술을 할 경우 불임, 유산, 미숙아 출산 등의 부작용 및 재발 가능성이 있어 근본적인 치료제가 필요한 상황이다.
높은 완치율의 GX-188E
제넥신은 수술 없이 자궁경부(전)암 치료가 가능한 암 치료 DNA 백신인 GX-188E 개 발에 주력하고 있다. GX-188E는 환자의 면역시스템을 활성화해 킬러 T 세포 면역반응 을 유도하여 HPV 감염세포만 선택적으로 제거되도록 유도하는 혁신 신약이다. 현재 자 궁경부전암, 자궁경부암에 대해 임상 진행 중이며, HPV 바이러스 감염으로 인한 생식기 암, 두경부암 등 다양한 암 종으로 적응증 확장이 기대되는 파이프라인이다.
암 치료 백신은 암 특이적 항원을 암환자에게 투여하여 면역시스템을 활성화시킴으로써 암을 치료하는 면역 치료제이다. 그리고 DNA 백신은 항원 유전자를 가진 DNA를 사람 에게 투여하여 항원에 대한 면역반응을 유도하는 기전을 갖는다. 한편 DNA 백신은 생 산단가가 비교적 낮고 재현성이 높으며 대량생산이 용이하다는 장점을 갖는다.
GX-188E의 플라스미드 DNA에는 HPV 바이러스 16/18 타입에서 특이적으로 발현하 는 항원 유전자(E6/E7)가 삽입되었다. 추가적으로 면역증강 유전자(Flt3L:extracellular Fms-like tyrosine kinase-3 ligand)를 도입하여 치료 효율을 높인 점이 특징적이다.
이렇게 암특이적 항원유전자와 면역증강 유전자가 도입된 플라스미드 DNA는 전기천공 법을 이용하여 팔 근육에 투여된다. 투여된 DNA는 HPV 특이적인 킬러 T세포(면역세 포)의 면역반응을 유도, 킬러 T세포가 HPV 감염세포를 선택적으로 제거하는 기전을 갖 는다. GX-188E는 외과적 수술방법 외에 옵션이 없는 자궁경부전암, 자궁경부암 환자에 게 비외과적인 안전한 치료법이 될 것으로 기대된다.
GX-188E 임상 결과
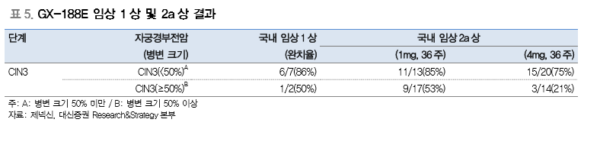
CIN3 환자 대상 임상 1상 결과: HPV 감염으로 인한 자궁경부전암 후기(CIN3)환자 대상으로 GX-188E 임상 1상이 진 행되었다. 총 3회에 걸쳐 GX-188E를 투여한 결과 총 9명의 CIN3 환자 중 7명의 환자 가 완치되어 86%에 달하는 치료율을 보였다. HPV 바이러스가 소멸되었으며 특히 완치 된 7명의 환자에게서 다기능 킬러 T세포의 높은 활성 유지가 확인되어 임상 결과가 국 제학술지인 Nature Communications(IF:12.124)에 게재되었다.
CIN3 환자 대상 임상 2a상
2016년 EUROGIN 학회에서는 CIN3 환자 대상 임상 2a상 중간 결과가 발표되었다. 1 차 평가항목은 자궁경부전암 1단계 및 그 이하로의 조직학적 퇴행을 확인하는 것이다. GX-188E 투여시 병변이 작은(병변 크기 50% 미만) 환자 그룹에서 85%의 효과가 나 타났으며 병변이 큰 환자에서는 50%의 효능을 보였다. 모든 병변 크기에서의 효능은 59%로 기간이 지남에 따라 효능이 증가되었다(20주 경과시 52%, 36주 경과시 59%). 또한 항원 특이적 킬러 T세포 반응이 90%이상으로 나타나 대부분의 환자에게서 항원 특이적인 면역반응이 유도되었다.
 |
유럽 및 한국 임상 2b상 진행 중. 예상되는 긍정적 결과
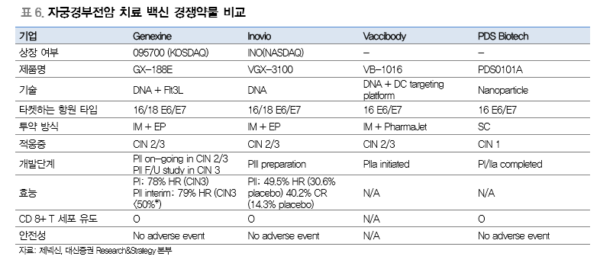
이를 바탕으로 제넥신은 유럽과 한국에서 임상 2b상을 진행하고 있다. 자궁경부전암 2단 계 및 3단계(병변 크기 50% 미만) 환자 134명을 대상으로 2a상과 동일한 투약용량으로 진행된다. 임상 2a상에서 병변 크기가 더 큰 환자에서도 효과를 보였기 때문에 임상 2b 상의 마일드한 병변의 환자에게서는 더 높은 치료효과가 기대된다. 2018년 상반기 임상 결과가 발표될 예정이며 이번 임상은 경쟁 약물을 개발하고 있는 Inovio사의 VGX3100와 동일하게 CIN2/3 환자를 대상으로 진행했기 때문에 두 약물간의 경쟁력 비교가 가능할 것으로 판단된다.
 |
GX-188E 시장가치의 증대. Keytruda 병용 투여로 자궁경부암까지 치료
면역관문억제제와 Keytruda
암세포는 PD-1(Programmed cell Death protein-1)에 의한 면역 세포(T 세포)의 감시를 피하기 위해 PD-L1을 발현하여 T 세포의 공격을 무력화한다. 최근에는 T 세포의 PD1 또는 암세포의 PD-L1과 결합하여 PD-1/PD-L1의 상호작용을 저해함으로써 T 세포 가 암세포를 공격할 수 있게 하는 면역관문억제제 개발이 활발히 이루어지고 있다.
Keytruda(pembrolizumab)는 Merck사에서 개발한 면역관문억제제로 PD-1에 결합하는 항체의약품이다. Keytruda는 전이성 흑색종, 비소세포암 및 재발성/전이성 두경부암, 난 치성 호지킨 림프종 등을 적응증으로 하여 FDA 승인을 받았다. Keytruda는 2016년 14 억 2백만달러, 2022년에는 113억 5천 1백만달러의 매출이 예상되는 차세대 블록버스터 의약품이다. 하지만 HPV 양성 암의 경우, Keytruda의 치료 반응률은 20.6%로 낮으며 동종 계열 치료제의 자궁경부암 반응률은 12.5%로 더욱 낮다. 이처럼 암종에 따라 Keytruda의 사용이 제한적이기 때문에 효능의 극대화를 위한 병용 요법이 요구된다.
Merck와 Keytruda + GX-188E 병용투여 임상 1b/2상 올 하반기 진행 예정
제넥신은 올 하반기부터 자궁경부암 환자(46명)를 대상으로 GX-188E와 Keytruda의 병 용요법 국내 임상 1b/2상을 진행할 예정이다. 이번 임상에서는 병용 투여시 안전성 및 항암 면역반응의 증가율을 확인할 예정이다.
제넥신은 자궁경부전암 환자를 대상으로 진행한 임상에서 GX-188E 투여시, 병변 제거 와 종양 특이적 항암면역반응이 효과적으로 유도되는 것을 확인하였다. 또한 암 동물 모 델에서는 GX-188E와 PD-1항체의 병용투여시 종양 크기 감소 및 생존율 증가 효과를 확인한 바 있다. 따라서 면역억제성 종양에 GX-188E를 투여시 HPV 특이적 T세포 반 응이 유도되고, 면역관문억제제인 Keytruda를 병용 투여하면 해당 면역 반응이 증가될 것으로 기대된다. 자궁경부전암에 이어 자궁경부암으로 적응증 확장시 GX-188E 파이프 라인의 가치는 더욱 증대될 것으로 예상된다.
 |
제넥신 기업 개요
제넥신은 포스텍 학내벤처로 시작한 바이오 기업으로 1999년 설립되어 2009년 기술 특례로 코스닥 시장에 상장했다. 제넥신은 독자적으로 개발한 기반기술인 1)항체융합단백 질 (Hybrid Fc, hyFc) 기술, 2)DNA 치료 백신기술을 바탕으로 바이오 신약을 개발하고 있다. 특히 항체융합단백질 치료제 파이프라인은 대부분 국내 및 해외 제약사와 공동개 발 및 임상시험을 진행 중이며, DNA 치료 백신은 글로벌 제약사 Merck의 차기 블록버 스터의약품과 병용투여 임상을 진행함으로써 기술력을 인정받고 있다.
현재 다양한 파이프라인이 임상 2상(6개), 임상 1b/2상(1개), 임상 1상(4개) 진행 중에 있으며 주로 면역항암제, 감염 및 대사성 질환 치료제에 특화되어 있다. 핵심 파이프라인 은 성장호르몬 결핍증 치료제인 지속형 성장호르몬 (GX-H9), 인유두종바이러스(HPV) 유래 자궁경부 전암 및 암에 대한 DNA 치료 백신(GX-188E)이다.
 |
 |
Valuation
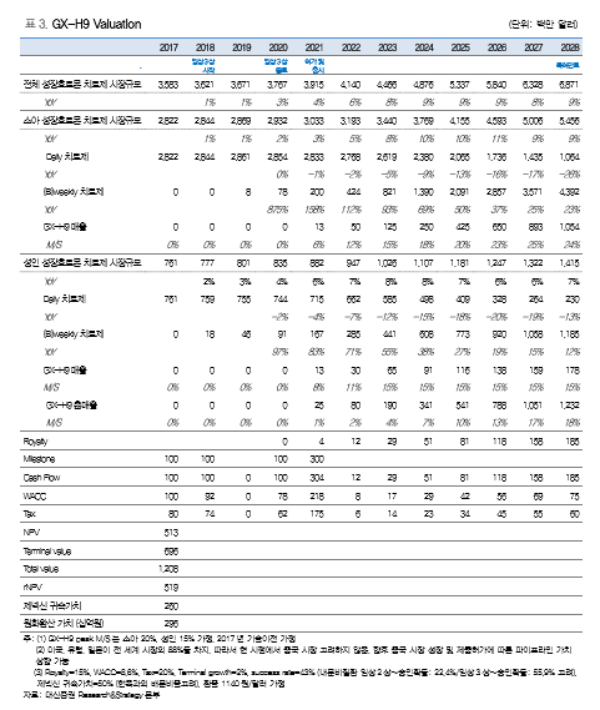
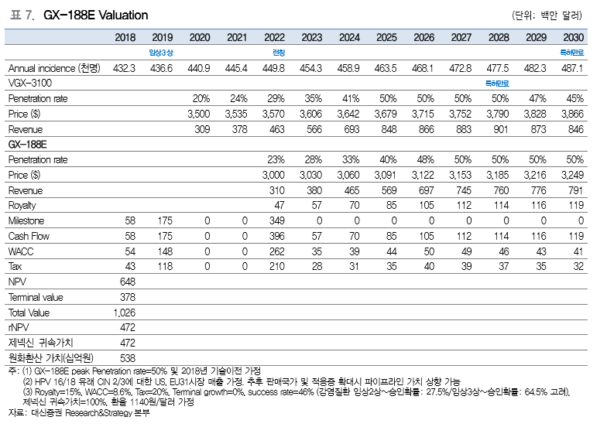
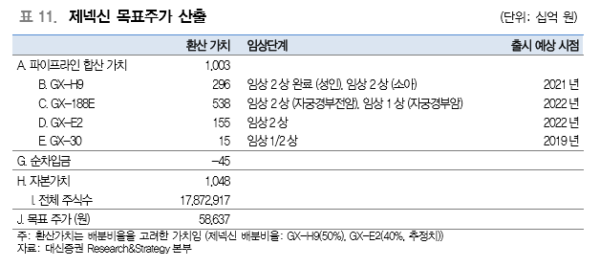
제넥신의 목표주가 59,000원은 현금흐름할인(Discounted Cash Flows; DCF)을 통해 주 요 파이프라인의 순현재가치(Net Present Value, NPV)를 산정한 뒤, 개발 단계별 성공확 률을 반영하여 위험조정 순현재가치(risk-adjusted NPV, rNPV)로 산출하였다. 잔여이익 모델(RIM)에서도 제넥신은 59,000원 상당의 가치를 보유하고 있다. 이는 2020년 이후 주요 파이프라인 매출 본격화에 따라 이익이 급성장하는 점이 반영되었다. <자료제공:대신증권>
 |
박병우 기자 bwpark0918@pharmstock.co.kr






